据科技日报报道,新冠疫苗一期临床试验开始人体注射实验,一批志愿者已注射。此前,中国工程院院士王军志在新闻发布会上表示,我国已有研发进展比较快的单位,向国家药监局滚动递交临床试验申请材料、并且已经开展临床试验方案论证、招募志愿者等相关工作。据了解, I期试验需要的志愿者并不多,仅限武汉地区常住居民,武昌、洪山、东湖风景区户籍居民优先,年龄18-60周岁。经过筛选和体检后,符合要求的志愿者可以接种疫苗。此后的14天,为集中隔离观察期。

疫苗与科学领域研究专家陶黎纳认为,这款腺病毒载体疫苗I期试验最快只需两周就可以拿到安全性方面的数据了。疫情当前,在这期间也可同时进行对抗体在体内的维持时间的试验观察,进一步加速后续试验。
行行查,行业研究数据库: www.hanghangcha.com
疫苗的总体开发通常包括临床研究、工艺开发以及鉴定方法的研究。(1)临床研究:主要分为临床前、临床1-3期以及上市后研究以确定其安全性、免疫原性和有效性。与药品不同,疫苗通常在临床研究时通过早期的人体概念验证试验后就有较大可能获批成功;(2)工艺开发:主要涉及准备符合临床试验监管要求的试验用疫苗,包括临床前毒理学研究和分析评估、多批次临床用疫苗以及最终放大的生产工艺,通常按照1/10或全量的生产规模连续生产3批疫苗供临床免疫原性研究使用,还要完成向正式生产车间大规模生产进行技术转移,包括生产工艺以及分析步骤。若临床3期所用的试验疫苗非生产车间大规模生产,则后续完善生产车间生产工艺后仍需要做桥接试验;(3)鉴定方法研究:涉及原料纯度检测方法的确定,疫苗产品的安全性和效力的检测,免疫学以及其他预测疫苗效果的检测标准,通常会采用功能性效力试验(开发合适的动物实验以及体外检测方法),一般来说。生物学检测方法的不稳定是实现工艺和生产一致性的主要障碍,生产阶段一般70%的时间都是用于产品检测与质控上面。是否继续研究的抉择贯穿临床试验以及工艺开发的每个阶段,并要用数据说明问题,因此临床、工艺以及鉴定的开发必须完整一体,每个环节相互交织在一起,每个过程都是限速步骤,必须协同。

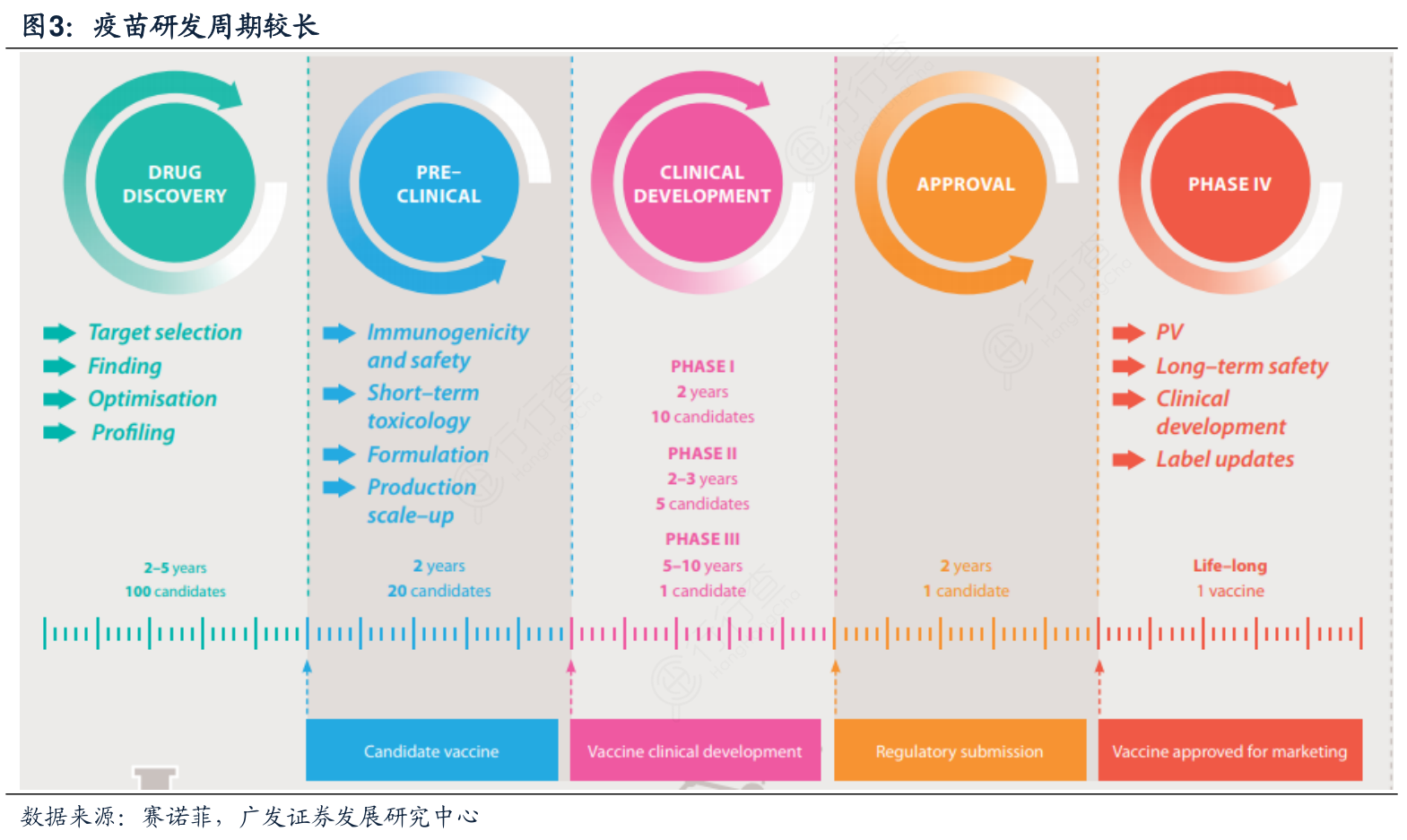
与传统药物的开发有很大的不同,疫苗的监管评估在技术上更具挑战性。例如,一些病原体可能发生突变,或具有不同的亚型,或很难激活免疫系统对疫苗作出反应等问题;这给开发疫苗增加了相当大的复杂性,有些疫苗含有多种成分(例如,有些疫苗含有23种不同的抗原)。此外,目标人群通常是健康的婴儿,这也增加了疫苗开发的复杂性。


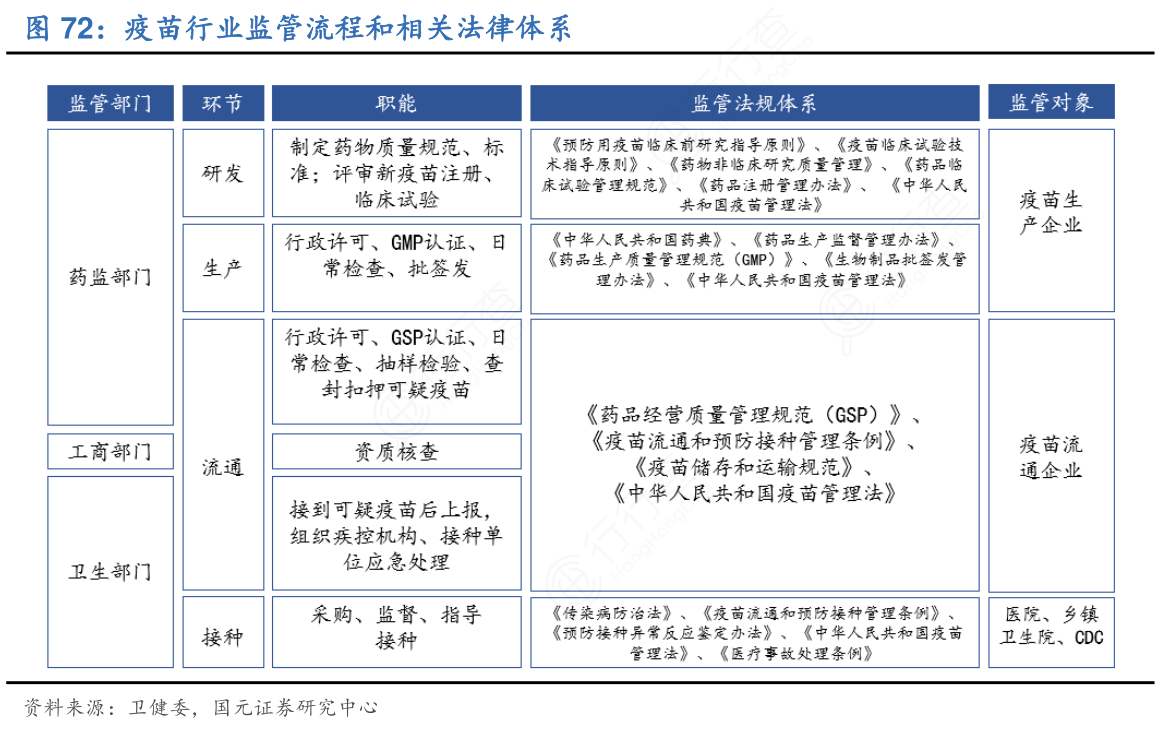
疫苗行业已形成了覆盖全生命周期的法律保障体系。监管部门主要包括药监局、工商部门和卫生部门,监管环节覆盖从研发到接种,监管对象包括疫苗厂商、流通企业和接种单位等,保障疫苗全流程安全。

行行查,行业研究数据库: www.hanghangcha.com
手机访问“行行查”小程序更方便
![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()
