12月18日,阿斯利康(AstraZeneca)和默沙东(MSD)联合宣布,美国FDA肿瘤学药物咨询委员会(Oncologic Drugs Advisory Committee, ODAC)以7:5的投票结果,支持双方联合开发的PARP抑制剂奥拉帕利(olaparib,英文商品名Lynparza)作为一线维持疗法,治疗转移性胰腺癌患者。今年8月,FDA已经接受奥拉帕利的补充新药申请(sNDA)并授予其优先审评资格,将在今年年底之前对这一申请作出回复。

PARP抑制剂的广阔前景已成为行业关注的热点,跨国药企和本土创新药企已经蓄势待发。目前国内关于奥拉帕利的临床试验已进入三期。对于患者来说利好的是,PARP抑制剂的竞争会推动行业发展,患者获益将会更多。
行行查,行业研究数据库 www.hanghangcha.com
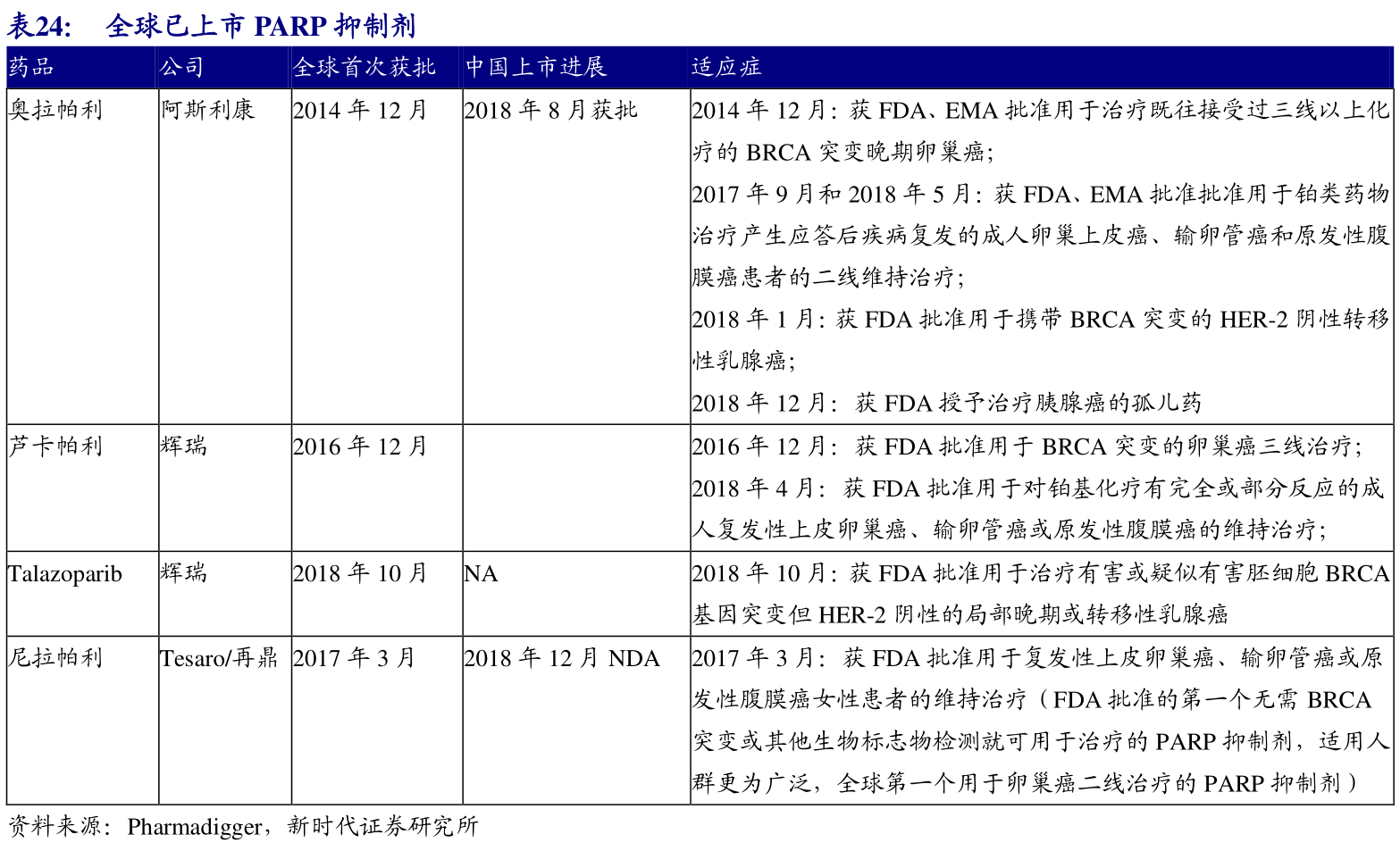
目前全球已有4个PARP抑制剂获批上市,适应症范围主要是卵巢癌、乳腺癌这两个领域,并且都是从三四线用药逐渐向一二线拓展。阿斯利康的奥拉帕利于2018年8月在国内获批上市,是国内第一个PARP抑制剂,也是国内第一个卵巢癌靶向药物,获批适应症为“用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗”。

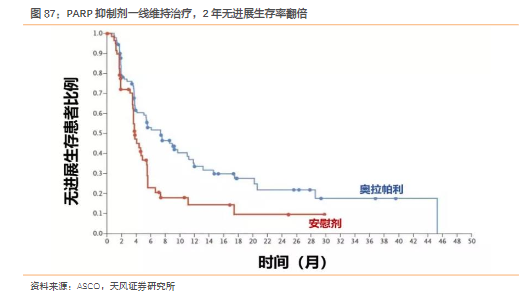
卵巢癌是奥拉帕利最早获批的适应症,此后通过不断积累临床证据,奥拉帕利在BRCA突变卵巢癌患者中的应用已经从四线单药治疗逐步扩展到二线、一线维持治疗,受益患者规模不断扩大。2019年ASCO会议公布的POLO研究纳入了154例接受一线含铂化疗后疾病未发生进展的胚系BRCA突变转移性胰腺癌患者,分别给予奥拉帕利(300mg每日2次)和安慰剂作为一线维持疗法,直至疾病进展,对比考察奥拉帕利与安慰剂在无进展生存等方面的疗效和安全性差异。结果显示,奥拉帕利作为一线维持疗法相比安慰剂使胰腺癌患者的无进展生存期翻倍(7.4 vs 3.8个月),疾病进展风险降低了47%(HR 0.53),1年无进展生存率翻倍(33.74% vs 14.5%),2年无进展生存率翻倍(22.1% vs 9.6%)。

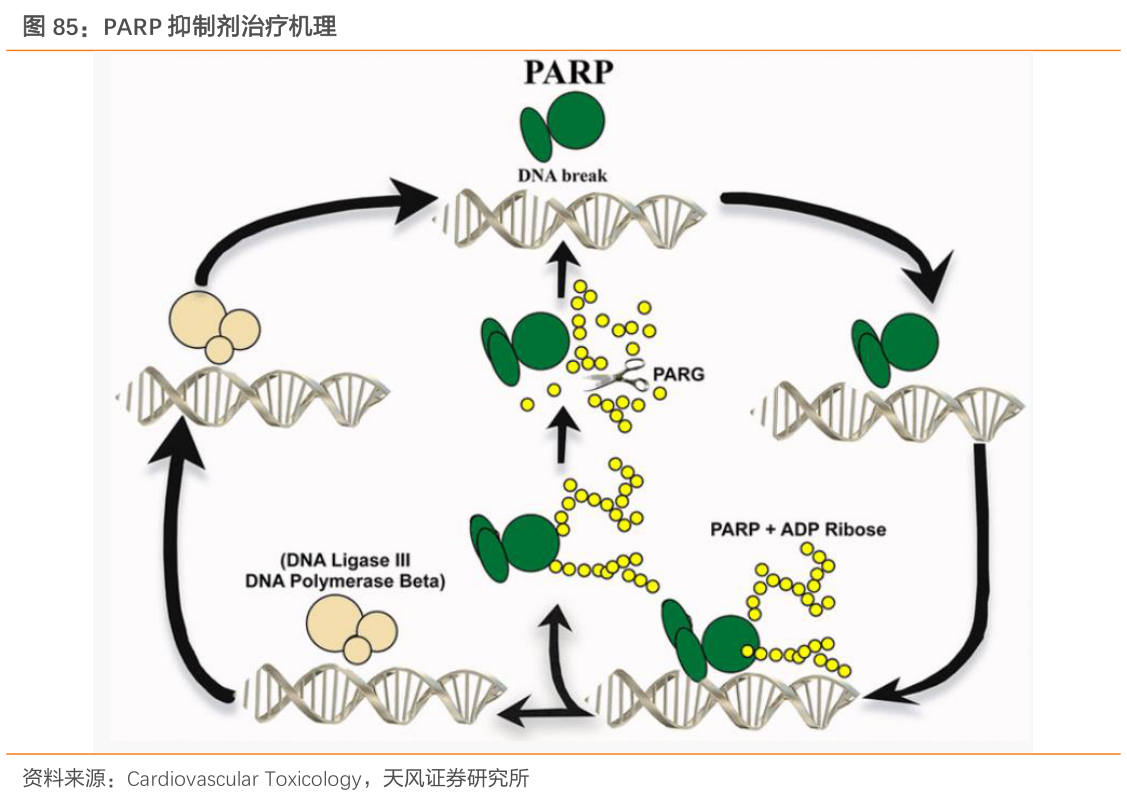
PARP(Poly ADP-ribose polymerase)全称为多聚腺苷二磷酸核糖聚合酶,是一种DNA修复酶,在DNA损伤修复、维持基因组稳定性方面起着重要作用。PARP抑制剂可抑制肿瘤细胞DNA损伤修复、增强肿瘤细胞DNA对损伤因素的敏感性,其是第一种成功利用合成致死概念获得批准上市的抗癌疗法。PARP抑制剂不仅可以在携带BRCA突变的乳腺癌和卵巢癌患者身上获得显著疗效,在携带BRCA突变的胰腺癌和前列腺癌患者身上亦能获得显著疗效。

行行查,行业研究数据库 www.hanghangcha.com
手机访问“行行查”小程序更方便
![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()
