近日,上海市公共卫生临床中心新发与再现传染病研究所宣布研发出新冠核酸(DNA)疫苗,并且该机构新冠疫苗团队的主要负责人徐建青已于2月26日亲自注射“第一针”。据悉,在注射第一针激发体内免疫后,徐建青还将于之后的两周左右注射第二针疫苗,以加强免疫。从2020年1月起,徐建青所在的团队开始同步进行核酸疫苗等大约10种疫苗的研发。而如今,核酸疫苗已在小鼠身上完成了动物试验,针对灵长类动物的动物试验正在进行;人源细胞载体疫苗也已经制备成功。

徐建青透露,第二针疫苗有点特别,这是全球首个以人源细胞为载体的疫苗。值得注意的是,这种新型核酸(DNA)疫苗以人源细胞为载体,把病毒的S蛋白表达在人的细胞膜上,因此能够极大地提高疫苗的安全性,总体达到快速、安全、高效的治疗效果。由于因为载体本身就是来自于人体细胞,这种疫苗不具有感染性,比病毒安全,研究人员还能进一步用新的基因工程技术对它的刺突蛋白进行改造。
行行查,行业研究数据库 www.hanghangcha.com
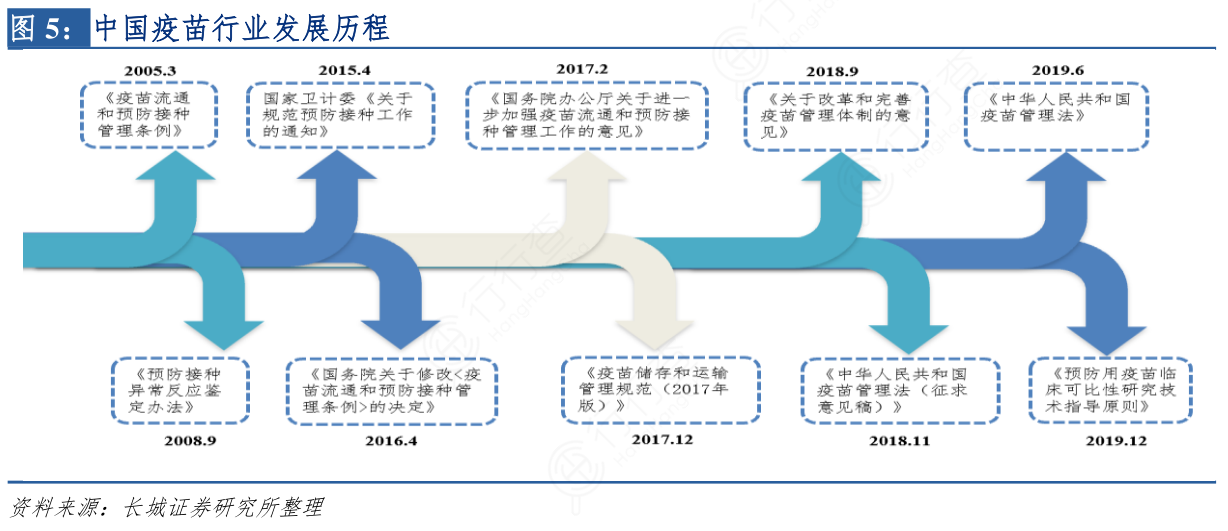
为加强对疫苗流通和预防接种的管理、预防、控制传染病的发生、流行,2005年3月24日国务院开始颁布《疫苗流通和预防接种管理条例》,国家逐渐重视疫苗行业,保障人体健康和公共卫生。2017年12月卫生部和国家食品药品监督管理局印发《疫苗储存和运输管理规范》,2018年9月中央全面深化改革委员会第四次会议审议通过了《关于改革和完善疫苗管理体制的意见》,直到2019年6月,十三届全国人大常委会第十一次会议表决通过了《中华人民共和国疫苗管理法》,国家首次颁布疫苗管理独立法,也是全球首部疫苗管理综合性法律,推进中国疫苗行业健康发展。

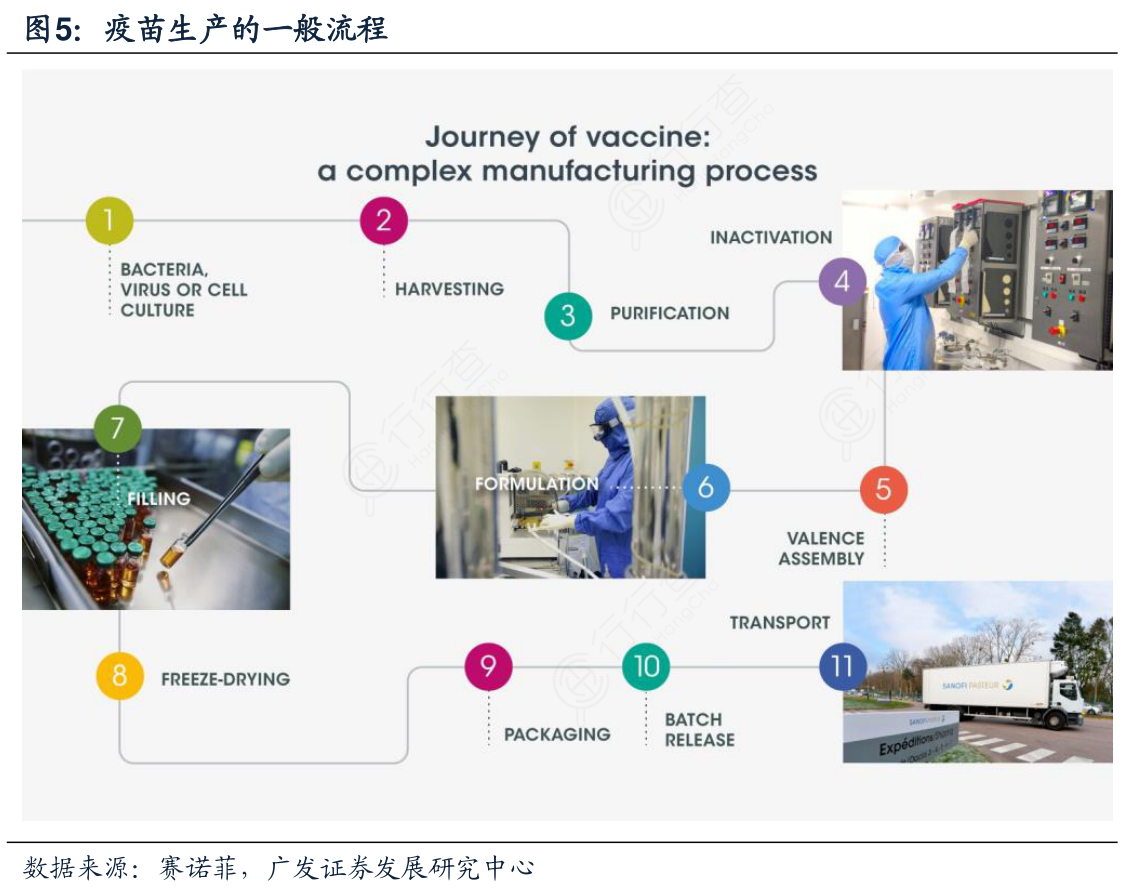
疫苗生产涵盖了制造疫苗的所有步骤:抗原生产、收获、纯化、灭活、配方(佐剂/防腐剂)、药物制备(灌装、检验和包装)的各个阶段以及质量控制,从生产流程上大致可以分为批生产与后处理,前者主要是生产出原液,后者是分装成制剂。疫苗的安全性、有效性通常与生产工艺的稳定性、鉴定方法以及质控体系密切相关。疫苗生产从小试、中试到向生产车间大规模生产的技术转移的过程中对生产工艺要求越来越高,需不断开发与优化,另外生产过程中70%的时间一般都用于检测与质控,因此原液生产对于疫苗制剂的质量至关重要。

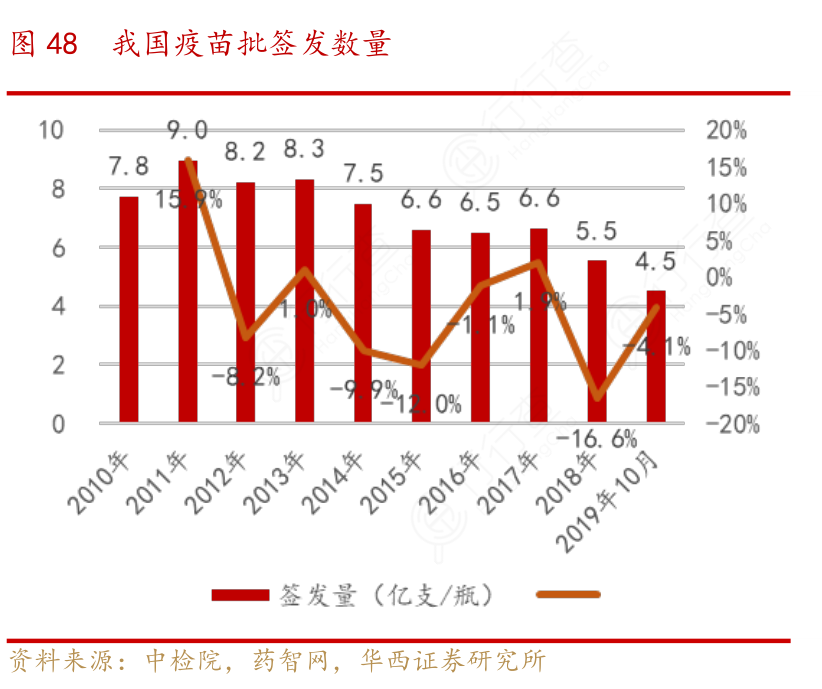
我国疫苗批签发整体数量从2011年开始逐渐从下降,到了2018年仅剩5.5亿支/瓶的批签发数量,但是我们可以看到,我国的疫苗市场产值从2016年以来却快速上升,2015-2018年行业复合增速高达34%,最主要的是新的大品种上市迅速推动整个市场空间大幅上升。

行行查,行业研究数据库 www.hanghangcha.com
手机访问“行行查”小程序更方便
![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()

![]()
